हेलों नमस्कार मेरे प्यारे साथियों स्वागत है आपका हमारे Arvindsirpata.com की इस लाजब वेबसाइट पर। आज हम आपको सेल और बैटरी का एक बहुत महत्वपूर्ण जानकारी देने वाले है की सेल किसे कहते हैं इसके बारे में विस्तार से बताने जा रहे हैं। रसायन विज्ञान के पाठ्यक्रम में सेल और बैटरी के विभिन्न प्रकारों के बारे में बताया गया है जिसमें से सेल या बैटरी एक बहुत मुख्य भाग है। अतः इसे जानना आपके लिए बहुत आवश्यक है।आज हम जिन महत्वपूर्ण प्रश्नों के बारे में बताने जा रहे है वे कुछ इस प्रकार है की सेल और बैटरी किसे कहते हैं सेल और बैटरी से क्या समझते हैं, सेल में कितना % अम्ल होता है, सेल और बैटरी में क्या अंतर है । यह कुछ ऐसे महत्वपूर्ण प्रश्न है जो बार-बार परीक्षा में पूछे जाते हैं, इस Article को पढ़ने के बाद आप कोई अच्छे से समझ में आ जायेंगा की सेल और बैटरी कितना महत्वपूर्ण है. अतः इन्हें आप अच्छे से याद कर लें और हमारे इस Article का लाभ उठाएं। तो चलिए बिना कोई देरी किये शुरू करते हैं हम अपना आज का आर्टिकल में सेल और बैटरी किसे कहते हैं।
सेलऔर बैटरी
सेल :-यह एक युक्ति है जिसमें इलेक्ट्रॉड के समूहो को सेल कहते है तथा सेलो के को बैटरी कहते है।
सेल का प्रकार
(i)प्राथमिक सेल (Primary Cell )
(ii)द्वितीयक सेल ( Secondary Cell )
(ii)ईंधन सेल (Fuel Cell )
प्राथमिक सेल (Primary Cell )
यह एक वैसी सेल है जिसमें रासायनिक ऊर्जा खत्म होने के बाद रेस्टोरे यानि इस सेल को पुनः चार्ज नहीं किया जा सकता है प्राथमिक सेल कहते है। या Non – Chargeable सेल को प्राथमिक सेल कहते है।Example :- शुष्क सेल ,मर्करी सेल
शुष्क सेल या लेक्लांचे सेल (Dry cell or Leclanche Cell ) :-
यह एक प्राथमिक सेल का उदाहरण है इस प्रकार के सेल के निर्माण मे जिंक ऐनोड की तरहव्यवहार करता है तथा ग्रेफाइट कैथोड की तरह व्यवहार करता है ग्रेफाइट का छड सेल के मध्य उपस्थित होता है।इस प्रकार के सेल मे विधुत रसायनिक अभिक्रियाहोती है जो इस प्रकार हैं
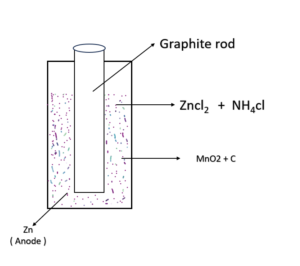
At anode (ऑक्सीकरण)
Zn → Zn2+ + 2e–
At Cathode(अवकरण)
Mno2 + NH4Cl + 2e– → MnO4(OH) + NH3
Zn + MnO2 + NH4Cl → Zn2+ Mno(OH) + NH3
( सेलअभिक्रिया )
मरकरी सेल
यह एक प्राथमिक सेल का उदाहरण है इसे हमलोग बटन सेल के नाम से जानते है इस सेल का उपयोग हाथ वाले घड़ी , सुनने वाला यंत्र इत्यादि मे उपयोग किया जाता है इस प्रकार के सेल जिंक अमलगम तथा कैथोड इलेक्ट्रान मर्करी ऑक्साइड का बना होता है |इस सेल मे इलेक्ट्रालाइट के रूप मे( KOH) भरा होता है |
At anode(ऑक्सीकरण)
2Zn + 4OH– →2 ZnO + 2H2O + 4e–
At cathode (अवकरण)
Hgo + H2o + 2e– → Hg + OH– ] x2
2Zn + 2Hgo + 2OH–→ 2ZnO + 2Hg
द्वितीयक सेल ( Secondary Cell )
यह यह ऐसी सेल है जिसमे रासायनिक ऊर्जा खत्म होने के बाद पुनः रासायनिक ऊर्जा को चार्ज करके ऊर्जा restore किया जाता है , द्वितीयक सेल कहलाता है |Example :- सीसा संचयक सेल ( लेड स्टोरेज सेल ), निकेल कोडेनियम सेल ( Ni –Cd सेल )
सीसा संचायक सेल
यह एक दितीयक सेल का उदाहरण है इस सेल मे बहुत सारे इलेक्ट्रॉड को आपस मे जोड़े जाते है प्रत्येक इलेक्ट्राड का विभव दो वोल्ट होता है सभी सेल को जोड़ा जाता है तबबैटरीबनता है |इस प्रकार के सेल मे ऐनोड लेड का बना होता है तथा कैथोड लेड ऑक्ससइड (PbO2 ) से बना होता है इन दोनों मे इलेक्ट्रॉड को 38% H2SO4घोल मे डूबा हुआ रहता है |सीसा संचायक सेल मे विधुत रासायनिक अभिक्रिया discharging के लिए इस प्रकार है |
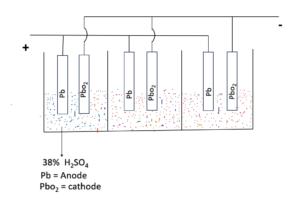
ऐनोड पर (ऑक्सीकरण)
Pb + So42+ 4 PbSo4 + 2e-
कैथोड पर (अवकरण)
Pbo2 + SO42- + 2H+ + 2e– →PbSo4 + 2H2o
Pb + Pbo2 + 2H2So4→ 2PbSo4 + 2H2o
Charging के लिए सेल :-
Anode :- PbSo4 + 2H2o à Pbo2 + So42- + 2e- + 2H+
Cathode :- PbSo4 +2e– →Pb + So42-
2PbSo4 + 2H2O→Pbo2 + Pb + 2H2So4
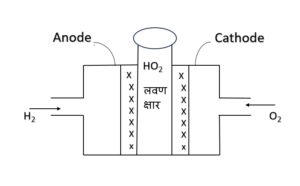
ईंधन सेल (फ्यूल सेल )
इंधन सेल की क्षमता सबसे अधिक होती है यह करीब 80% रासायनिक ऊर्जा को विधुत ऊर्जा मे बदल देता है यह बहुत कम ही समय मे अपनी क्रियाशीलता मे आ जाती है यह सीधे इंधन मे होने वाली प्रतिक्रिया से विद्युतीय ऊर्जा उत्पन्न करता है | इस सेल मे इंधन जैसे H2, O2 , CH4 , C कोयला इत्यादि पदार्थ का उपयोग किया जाता है | अन्तः इसे इंधन सेल कहा जाता है |कुछ महत्वपूर्णइंधन सेल H2 – O2सेल सफल इंधन सेल है इसमे H2 एवं O2द्वारा ऊर्जा उत्पन्न किया जाता है इस सेल मे निम्नलिखित अभिक्रियाएँ होती है।