वैद्युत संयोजक या आयनिक बंधन (Electrovalent or Ionic bond)
– दो परमाणुओं के बीच इलेक्ट्रॉनों के पूर्ण स्थानांतरण के फलस्वरूप बने रासायनिक बंधन को वैद्युत संयोजक या आयनिक बंधन कहते हैं।
जैसे – सोडियम क्लोराइड में सोडियम तथा क्लोरीन परमाणु के बीच आयनिक बंधन है।
Na + Cl → Na++ Cl–
सहसंयोजक बंधन (Covalent bond)
– दो परमाणुओं के बीच इलेक्ट्रॉनों की साझेदारी के फलस्वरूप बने बंधन को सहसंयोजक बंधन कहते हैं।
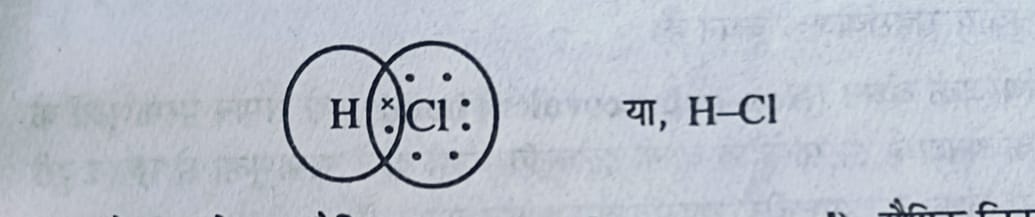
जैसे – HCl में हाइड्रोजन तथा क्लोरीन परमाणुओं के बीच एक-एक इलेक्ट्रॉनों की साझेदारी के फलस्वरूप एक सहसंयोजक बंधन बनता है।
वैद्युत संयोजक यौगिक (Electrovalent compound)
यौगिक जिनके अणुओं में परमाणुओं के बीच आयनिक बंधन होता है, उन्हें वैद्युत संयोजक यौगिक कहते हैं।
जैसे – सोडियम क्लोराइड, मैग्नीशियम क्लोराइड, कैल्सियम क्लोराइड, सोडियम ऑक्साइड आदि।

वैद्युत संयोजक यौगिक और सहसंयोजक यौगिक में अंतर –
| वैद्युत संयोजक यौगिक
| सहसंयोजक यौगिक
|
| 1. इनके अवयवी कण आयन होते हैं।
| 1. इनके अवयवी कण अणु होते हैं।
|
| 2. ये परमाणुओं के बीच इलेक्ट्रॉनों के पूर्ण स्थानांतरण के फलस्वरूप बनते हैं।
| 2. ये इलेक्ट्रॉनों के बीच पारस्परिक साझेदारी के फलस्वरूप बनते हैं।
|
| 3. इनके क्वथनांक एवं द्रवणांक उच्च होते हैं।
| 3. इनके क्वथनांक एवं द्रवणांक निम्न होते हैं।
|
| 4. ये विद्युत के कुचालक होते हैं, लेकिन द्रव अवस्था या विलयन में विद्युत के सुचालक होते हैं।
| 4. ये विद्युत के कुचालक होते हैं।
|
| 5. ये जल में घुलनशील होते हैं परन्तु कार्बनिक विलायकों में अघुलनशील होते हैं। | 5. ये जल में अघुलनशील लेकिन कार्बनिक विलायकों (जैसे – बेंजीन, ईथर आदि) में घुलनशील होते हैं।
|
| 6. विलयन में इनकी अभिक्रियाएँ धीरे-धीरे होती हैं।
| 6. जलीय विलयों में तीव्रता से अभिक्रिया करते हैं।
|
| 7. ये मुख्यतः क्रिस्टलीय ठोस पदार्थ होते हैं।
| 7. ये प्रायः ठोस या द्रव होते हैं।
|
| 8. इनके अणुओं की एक निश्चित ज्यामितीय आकृति होती है।
| 8. इनके अणुओं की कोई निश्चित आकृति नहीं होती है। |