जल की संरचना
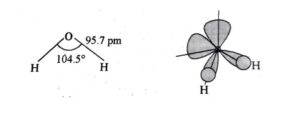
जल के अणु (H2O) में ऑक्सीजन पर sp3 संकरण होता है तथा इसमें ऑक्सीजन पर दो एका की इलेक्ट्रॉन युग्म उपस्थित होने के कारण गैस अवस्था में इसकी आकृति V- जैसी, कोणीय या बंकित (bent) होती है।
1.p – 1.p प्रतिकर्षण के कारण बन्ध कोण का मान 104.5° हो जाता है तथा इसमें O – H बन्ध लम्बाई 95.7pm होती है।
जल के भौतिक गुण
- जल एक रंगहीन, गंधहीन तथा स्वादहीन द्रव है।
- जल की विशिष्ट ऊष्मा , तापीय चालकता, पृष्ठतनाव, द्विध्रुव आघूर्ण तथा परावैद्युतांक (78.39) के मान भी उच्च होते हैं जो कि अन्य द्रवों की तुलना में अधिक हैं।इन्हीं विशिष्ट गुणों के कारण जीव मण्डल में जल की महत्त्वपूर्ण भूमिका होती है।
- जल का हिमांक (273K), क्वथनांक (373K), वाष्प न ऊष्मा तथा संलयन ऊष्मा उच्च होती है।इन सबका कारण जल के अणुओं के मध्य अन्तरा अणु कहा इड्रोजन बंध है।
- 298K ताप पर जल का घनत्व 00g / cm3 होता है, लेकि न इसका अधिकतम घनत्व 277K ताप पर होता है।जल उदासीन होता है।
- जल की विशिष्ट चालकता बहुत कम होती है क्योंकि इसका आयन न कम होता है।
- जल की उच्च वाष्प न ऊष्मा तथा उच्च ऊष्माधारिता ही जीवों के शरीर तथा जलवायु के ताप को सामान्य बनाए रखने के लिए उत्तरदायी है।
- वनस्पतियों तथा प्राणियों के उपापचय में अणुओं के अभिगमन के लिए जल एक विलायक के रूप में कार्य करता है।
- जल, ध्रुवीय सहसंयोजक यौगिकों के साथ हाइड्रोजन बंध बनाता हैअतः ये यौगिक जल में विलेय होते हैं जैसे, ऐल्कोहॉल, ग्लिसरॉल तथा कार्बोहाइड्रेट (ग्लूकोस, शर्करा) इत्यादि।
जल के रासायनिक गुण
- उभयधर्मी प्रकृति:-जल का स्वतःआयनन ( स्वतःप्रोटोनीअपघटन ) निम्न प्रकार होता है—
H2O (l) अम्ल- 1 + H2O (l) क्षार -2 ⇌ H3O+ (aq) अम्ल -2 + OH– (aq) क्षार -1
अतः ब्रेन्स्टेदलॉरी के अनुसार यह प्रोटॉन दे भी सकता है तथा प्रोटॉन ग्रहण भी कर सकता है इसलिए यह उभयधर्मी होता है।क्षारों के साथ यह म्लकी तरह तथा अम्लों के साथ यह क्षार की भाँति कार्य करता है
- जल अपघटन:- जल में बहुत से आयनिक यौगिक विलेय होते हैं क्योंकि इसका परावैद्युतांक का मान उच्च होता हैअतः इसमें जलयोजन की प्रवृत्ति होती है।लेकिन बहुत से यौगिक जल से क्रिया करके विभिन्न उत्पाद बनाते हैं, इसे जल अपघटन कहते हैं।जल अपघटन में जल द्वारा यौगिक का विघटन हो कर नए यौगिक बनते हैं। उदाहरण
P4O10 (s) + 6H2O (l) → 4H3PO4 (aq)
SiCl4 (l) + 2H2O (l) → SiO2 (s) + 4HCl (aq)
कठोर एवं मृदु जल
सामान्यतः वर्षा का जल लगभग शुद्ध होता है।यह जल जब पृथ्वी की सतह पर बहता है तो इसमें बहुत से लवण घुल जाते हैं इससे जल कठोर हो जाता है।जल की कठोरता जल में विलेय कैल्सियम तथा मैग्नीशियम के कार्बोनेट , क्लोराइड तथा सल्फेट के कारण होती है।अतःजल दो प्रकार का होता है – मृदु जल तथा कठोर जल।
मृदु जल :-
मृदु जल वह होता है जिसमें विलेयशील कैल्सियम तथा मैग्नीशियम लवण नहीं होते हैं तथा यह साबुन के साथ आसानी से झाग दे देता है।
कठोर जल :-
वह जल जिसमें विलेयशील कैल्सियम तथा मैग्नीशियम लवण, कार्बोनेट क्लोराइड तथा सल्फेट के रूप में उपस्थित होते हैं, उसे कठोर जल कहते हैं।यह साबुन के साथ आसानी से झाग नहीं देता है।
जल की कठोरता दो प्रकार की होती है—
- अस्थायी कठोरता
- स्थायी कठोरता
अस्थायी कठोरता
अस्थायी कठोरता जल में कैल्सियम एवं मैग्नीशियम के बाइकार्बोनेट (हाइड्रोजनकार्बोनेट) की उपस्थिति के कारण होती है।इसे अस्थायी कठोरता इसलिए कहा जाता है क्योंकि इसे जल को गरम करने, उबालने अथवा आसवन द्वारा दूर किया सकता है।सामान्यत या जल की अस्थायी कठोरता को 1.उबालकर तथा 2.क्लार्क विधि द्वारा दूर करते हैं।
स्थायी कठोरता
जल की स्थायी कठोरता का कारण उस में विलेय कैल्सियम तथा मैग्नीशियम के क्लोराइड तथा सल्फेट के कारण होती है।यह कठोरता जल को उबालकर दूर नहीं की जा सकती है।स्थायी कठोरता की पहचान यह है कि इस जल में साबुन झाग नहीं देता है नही इसमें फसल अच्छी होती है और नही यह पाचन क्रिया में लाभकारी है।निम्नलिखित विधियों द्वारा जल की स्थायी कठोरता को दूर किया जा सकता है
- धावन सोडा (सोडियम कार्बोनेट) द्वारा
- परम्युटिट विधि या आयन विनिमय विधि द्वारा
- केलगॉन विधि द्वारा
- आयन विनिमयक संश्लेषित रेजिन्स द्वारा