विलयन, समांगी तथा असमांगी मिश्रण , समांगी मिश्रण, असमांगी मिश्रण, विलयनों के प्रकार , सांन्द्रता, विलयन की सान्द्रता को पाँच तरह से परिभाषित, द्रव्यमान प्रतिशत (w/w), आयतन प्रतिशत (V/V),द्रव्यमान आयतन प्रतिशत (w/V), मोललता, मोल अंश या मोल प्रभाज या मोल भिन्न, पीपीएम (PPM-parts per million), ठोस की द्रव में विलेयता,1. विलेय तथा विलायक की प्रकृति, 2. तापमान, 3. दाब, हेनरी का नियम , हेनरी के नियम के अनुप्रयोग, राउल्ट का नियम, आदर्श विलयन और अनादर्श विलयन, अनादर्श विलयन, अनादर्श विलयन के प्रकार, आदर्श विलयन और अनादर्श विलयन में अंतर, अणु संख्य गुण, वाष्पदाब का आपेक्षिक अवनमन, क्वथनांक , क्वथनांक का उन्नयन, हिमांक में अवनमन, परासरण, परासरण की क्रिया के प्रकार,अर्द्ध पारगम्य झिल्ली, परासरण और विसरण में अन्तर, परासरण को प्रभावित करने वाले कारक , विलेय के अणुओं के अणुभार ज्ञात करना , असामान्य मोलर द्रव्यमान , असमान्य मोलर द्रव्यमान में संशोधन , वांट हॉफ गुणांक के उपयोग, वांट हॉफ गुणांक i , आयनन की मात्रा की गणना करना , संयोजन की मात्रा की गणना करना |
विलयन














दो या दो से अधिक अवयवो के समांगी मिश्रण को विलयन कहते है ।
जैसे – नमक पानी का मिश्रण एक समांगी मिश्रण है यह एक विलयन का उदहारण है ।विलयन में दो अवयवो से मिलकर बने होते है विलेय तथा विलायक
विलेय :- विलयन में जिस अवयवो की मात्र कम होती उसे विलेय कहते है ।
जैसे :- चीनी पानी के घोल में , चीनी विलेय होता है ।
विलायक :-विलयन में जिस अवयवो की मात्र अधिक होती उसे विलेय कहते है ।
जैसे :- चीनी पानी के घोल में , पानी विलायक होता है।
विलयन का सांद्रण ( Concentration of Solution )
विलयन में उपस्थित विलेय का आपेछिक मात्रा को विलयन का सांद्रण कहते है । विलयन का सांद्रण निमंलिखित प्रकार से व्यक्त किया जाता है
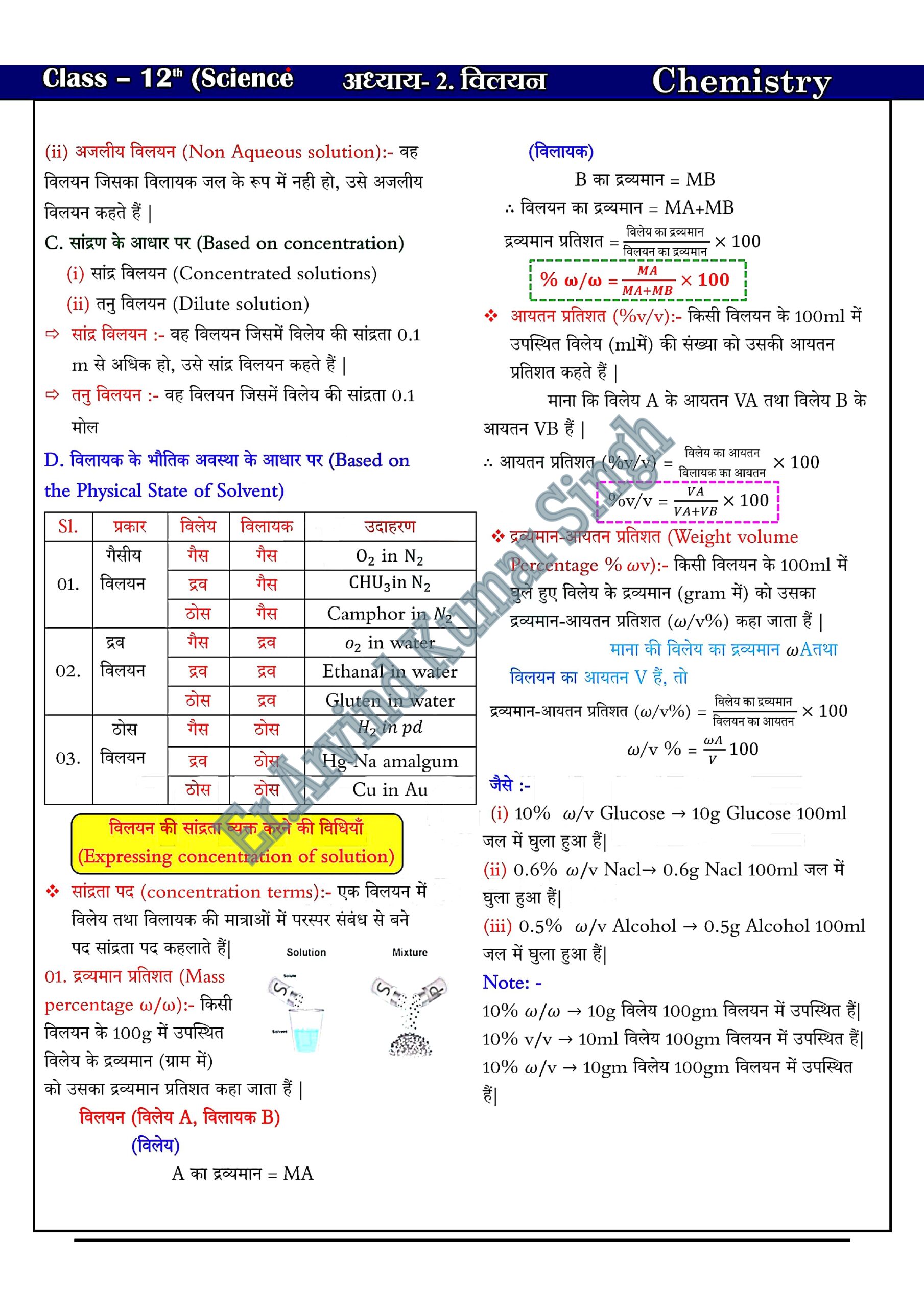
द्रव्यमान प्रतिशत ( % W/W)
यह 100 ग्राम विलयन में उपस्थित विलेय के ग्राम मात्रा को प्रदर्शित करता है
% W/W= विलेय का भार (gm ) / विलयन का भार x 100
द्रव्यमान प्रति आयतन प्रतिशत ( % W/V)
यह 100 ग्राम विलयन में उपस्थित विलेय के ml (मिली लीटर) मात्रा को प्रदर्शित करता है
% W/V= विलेय का भार (gm ) / विलयन का आयतन (ml) x 100
आयतन प्रतिशत ( % V/V)
यह 100 ml विलयन में उपस्थित विलेय के ml (मिली लीटर) मात्रा को प्रदर्शित करता है
% W/V= विलेय का आयतन (ml) / विलयन का आयतन (ml) x 100
मोलरता (M)
:- एक लीटर या 1000 ml विलयन में उपस्थित विलेय के मोलो की संख्या ,विलयन की मोलरता कहलाती है।
M = विलेय के मोलों की संख्या (Mol) / विलयन की आयतन (लीटर)
M = विलेय की भार (gm) / विलेय का भार (gm) x 1000 / विलयन की आयतन (litre)
Unit = मोल / लीटर


मोललता (m)
:- एक किलो या 1000 ग्राम विलायक में उपस्थित विलेय के मोलो की संख्या, मोललता कहलाती है।
m = विलेश के मोलों की संख्या (Mol) / विलायक का भार (kg में )
m = विलेय की भार (gm) / विलेय का भार (gm) x 1000 / विलायक का भार (kg में )
Unit = मोल / kg
नॉर्मलता (N)
एक लीटर विलयन में उपस्थित विलेय की के ग्राम तुल्यांक की संख्या, विलपन की नॉर्मलता कहलाती है।
N = विलेय की के ग्राम तुल्यांकों की संख्या / विलयन की आयतन (लीटर में )
N= विलेय का भार (gm )x संयोजी गुणाक (v.f )/विलेय का अनुभार (M.W) विलयन का आयतन (लीटर में)
Unit= ग्राम तुल्यांक पर लीटर
नॉर्मलता और मोलरता के बीच संबंध –
नॉर्मलता = मोलरता x संयोजी गुणाक
N=M x V.F

12th Chemistry Chapter 2 Hindi Medium Notes -compressed